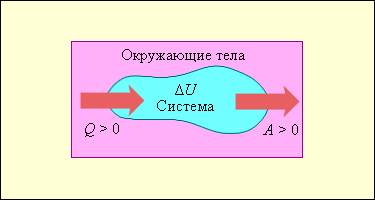
Уравнение первого закона термодинамики является фундаментальным законом, описывающим сохранение энергии в термодинамической системе. Это уравнение позволяет установить связь между изменением внутренней энергии системы, выполненной работой и переданным ей теплом.
В основе уравнения лежит принцип сохранения энергии, согласно которому энергия не может быть создана или уничтожена, а только переходить из одной формы в другую. Уравнение первого закона термодинамики можно записать следующим образом:
ΔU = Q — W
где ΔU — изменение внутренней энергии системы, Q — количество тепла, поглощенного системой, W — работа, выполненная над системой.
Это уравнение является основой для понимания теплотехнических процессов и энергетических систем. Оно позволяет определить изменение энергии системы, исходя из количества переданного тепла и работы, выполненной системой или над системой.
При применении уравнения первого закона термодинамики необходимо учитывать знаки переданных величин. Если тепло или работа поглощаются системой, то соответствующие величины имеют положительный знак. Если тепло отдается системой или работа выполняется над системой, то знаки этих величин отрицательные. Таким образом, уравнение первого закона термодинамики позволяет анализировать энергетические процессы и определять направление энергетических потоков в системе.
Определение и суть уравнения
Формально уравнение первого закона термодинамики можно записать следующим образом:
ΔU = Q — W
Где:
- ΔU — изменение внутренней энергии системы;
- Q — количество теплоты, полученной системой или отданной системе;
- W — работа, произведенная над системой или работа, выполненная системой.
Уравнение первого закона термодинамики позволяет установить взаимосвязь между изменением внутренней энергии, полученным теплом и выполненной работой в системе. Оно играет ключевую роль в изучении термодинамических процессов и используется для решения различных задач в области физики и техники.
Термодинамика и ее предмет изучения
В основе термодинамики лежит первый и второй законы, которые определяют основные принципы работы термодинамической системы. Уравнение первого закона термодинамики позволяет описывать сохранение энергии в системе и связывает изменение внутренней энергии системы с тепловым и работовым взаимодействием.
Изучение термодинамики позволяет понять, как работает широкий спектр систем — от паровых двигателей и холодильников до процессов, происходящих в живых организмах. Также термодинамика находит применение в многих отраслях науки и техники, включая химию, физику и инженерное дело.
Целью изучения термодинамики является понимание основных законов и принципов, которые определяют, как системы обмениваются энергией и какие процессы происходят при этом. Это позволяет инженерам и ученым разрабатывать более эффективные и устойчивые технологии, а также предсказывать и объяснять различные явления, происходящие в природе и в технических системах.
Уравнение первого закона термодинамики: формулировка
Уравнение первого закона термодинамики может быть записано следующим образом:
- Внешняя энергия, передаваемая системе в виде работы, равна изменению внутренней энергии системы плюс количеству тепла, переданного системе.
- Изменение внутренней энергии системы можно выразить как разницу между конечной и начальной внутренней энергией системы: ΔU = Uконечная — Uначальная.
- Количество тепла, переданного системе, может быть выражено как разница между полученным количеством тепла и отданным количеством тепла: Q = Qполученное — Qотданное.
Таким образом, уравнение первого закона термодинамики может быть записано в следующем виде:
Внешняя энергия = ΔU + Q
где ΔU — изменение внутренней энергии системы, Q — количество тепла, переданного системе.
Это уравнение позволяет описать взаимосвязь между работой, теплом и изменением внутренней энергии системы, что играет важную роль в изучении термодинамики.
Принципы и основные понятия
Основными понятиями, используемыми в уравнении первого закона термодинамики, являются:
- Внутренняя энергия — это энергия, связанная с молекулярными и атомными взаимодействиями внутри системы. Она зависит от состояния системы и может изменяться при взаимодействии с окружающей средой.
- Тепло — это энергия, которая передается между системой и окружающей средой в результате теплового обмена. Тепло может переходить как вследствие разности температур, так и другими способами передачи энергии.
- Работа — это энергия, которая передается или получается системой при совершении механической работы над окружающей средой или внутри системы. Работа может быть совершена при сжатии/расширении газов или при перемещении тел.
Принципы, лежащие в основе уравнения первого закона термодинамики, включают:
- Принцип сохранения энергии — энергия не может быть создана или уничтожена, она может только изменять свою форму или передаваться между системой и окружающей средой.
- Принцип равенства теплообмена — тепло, переданное системе, равно теплу, переданному окружающей среде.
- Принцип равенства работы — работа, выполненная системой, равна работе, совершенной над системой или внутри системы.
Использование уравнения первого закона термодинамики позволяет анализировать изменения внутренней энергии системы, количество тепла и работы, произведенной или полученной системой. Это является основой для изучения различных процессов, таких как изменение температуры, изменение объема газовой смеси или химические реакции.
Внутренняя энергия системы
Внутренняя энергия зависит от состояния системы и может изменяться в результате передачи тепла или работы.
Основное свойство внутренней энергии системы — ее изменение равно работе, совершенной системой, и переданному ей количеству тепла. Если система не меняет свое состояние, то внутренняя энергия остается постоянной.
Внутренняя энергия системы можно выразить формулой:
U = Q — W
где U — внутренняя энергия системы, Q — количество тепла, переданное системе, а W — работа, выполненная системой.
Изменение внутренней энергии системы также можно выразить формулой:
ΔU = ΔQ — ΔW
где символ delta (Δ) обозначает изменение величины.
Понимание внутренней энергии системы является важным для понимания термодинамики и прогнозирования поведения системы в различных условиях.
Теплота и работа в уравнении
В уравнении есть два основных понятия — теплота и работа. Теплота — это энергия, передаваемая между системой и окружающей средой в виде теплового движения частиц. Работа — это энергия, передаваемая или получаемая системой в результате механического движения ее границы.
Определить относительное значение теплоты и работы можно с помощью уравнения первого закона термодинамики:
| Q | = | ΔU | + | W |
|---|
где Q — теплота, передаваемая системой; ΔU — изменение внутренней энергии системы; W — работа, совершаемая системой.
Знак «+» перед работой означает, что работа совершается системой, а знак «-» означает, что работа совершается над системой.
Таким образом, уравнение позволяет определить, какая часть энергии, поступающей в систему в виде теплоты, используется для изменения ее внутренней энергии, а какая часть превращается в работу.
Применение уравнения первого закона термодинамики
Одной из важных областей, где применяется уравнение первого закона термодинамики, является энергетика. Оно помогает рассчитать изменения энергии в системе и определить эффективность работы энергетических установок. Например, применение уравнения позволяет оценить КПД котлов, турбин, двигателей и других устройств.
Уравнение первого закона термодинамики также находит применение в химии при анализе химических реакций и процессов. Оно позволяет рассчитать изменение внутренней энергии системы и определить количество тепла, поглощенного или выделившегося при химической реакции. Это важно для понимания химических процессов и разработки новых веществ и материалов.
Также уравнение первого закона термодинамики применяется в гидродинамике, аэродинамике и других областях механики. Оно используется для расчета работы и эффективности различных механизмов, таких как насосы, компрессоры, двигатели, воздушные и гидравлические системы.
Важно отметить, что уравнение первого закона термодинамики не может быть применено к процессам с необратимыми потерями энергии, таким как трение или теплоотвод. Однако оно все равно является мощным инструментом для анализа и понимания различных физических процессов и может быть использовано для разработки более эффективных систем и устройств.
Процессы, описываемые уравнением
Уравнение первого закона термодинамики выглядит следующим образом:
ΔU = Q — W,
где ΔU — изменение внутренней энергии системы, Q — количество тепла, поглощенного или отданного системой, W — работа, совершенная над системой.
С помощью этого уравнения можно описать различные процессы, включая следующие:
-
Изотермический процесс: процесс, при котором температура системы остается постоянной. В таком случае, изменение внутренней энергии системы будет равно нулю (ΔU = 0). Уравнение первого закона термодинамики для изотермического процесса принимает вид Q = W, что означает, что количество тепла, поглощаемое или отдаваемое системой, равно производимой работе.
-
Адиабатический процесс: процесс, при котором нет обмена теплом между системой и окружающей средой (Q = 0). В таком случае, уравнение первого закона термодинамики принимает вид ΔU = -W, что означает, что изменение внутренней энергии системы равно минус работе, совершенной над системой.
-
Изохорный процесс: процесс, при котором объем системы остается постоянным (dV = 0). В таком случае, уравнение первого закона термодинамики принимает вид ΔU = Q, что означает, что изменение внутренней энергии системы равно количеству поглощенного тепла.
-
Изобарный процесс: процесс, при котором давление системы остается постоянным. Уравнение первого закона термодинамики для изобарного процесса принимает вид ΔU = Q — PΔV, где P — давление, ΔV — изменение объема системы. Это уравнение позволяет определить изменение внутренней энергии системы при изменении ее объема и обмене теплом при постоянном давлении.
Таким образом, уравнение первого закона термодинамики позволяет описывать и анализировать различные процессы, происходящие в системе, и определить их свойства и параметры.
Вопрос-ответ:
Что такое уравнение первого закона термодинамики?
Уравнение первого закона термодинамики, также известное как закон сохранения энергии, устанавливает, что изменение внутренней энергии системы равно количеству теплоты, подведенной к системе, плюс работе, выполненной над системой.
Какое значение имеет уравнение первого закона термодинамики для изучения тепловых процессов?
Уравнение первого закона термодинамики является основным уравнением, которое позволяет изучать тепловые процессы и связанные с ними изменения энергии в системе. Оно помогает определить изменение внутренней энергии системы при различных условиях и позволяет рассчитать работу и теплоту, связанные с процессом.
Каким образом можно применять уравнение первого закона термодинамики в инженерных расчетах?
Уравнение первого закона термодинамики позволяет инженерам расчитать энергетические потоки, работу и теплоту, связанные с различными процессами. Например, оно используется в расчетах для определения эффективности тепловых двигателей или для оценки энергетических потерь в системах. Также оно позволяет определить изменение внутренней энергии системы при различных условиях и вариантах работы с ней.
Как уравнение первого закона термодинамики связано с законом сохранения энергии?
Уравнение первого закона термодинамики является математическим выражением закона сохранения энергии. Оно устанавливает, что энергия не может быть создана или уничтожена в изолированной системе, она может только переходить из одной формы в другую или перемещаться между системой и окружающей средой в виде работы и теплоты.